
Sodyum ve potasyumun kimyasal özellikleri nelerdir?
Sodyum ve potasyum, alkali metaller grubunda yer alan iki önemli elementtir. Bu makalede, her iki elementin kimyasal özellikleri, biyolojik önemi ve endüstriyel kullanımları detaylı bir şekilde incelenmektedir. Sodyum ve potasyumun reaktivitesi, insan sağlığı ve sanayi üzerindeki etkileri ele alınmaktadır.
Sodyum ve Potasyumun Kimyasal Özellikleri Sodyum (Na) ve potasyum (K), periyodik tablonun alkali metaller grubunda yer alan iki önemli elementtir. Her ikisi de doğada bol miktarda bulunur ve birçok biyolojik ve endüstriyel süreçte kritik rollere sahiptir. Bu makalede, sodyum ve potasyumun kimyasal özellikleri detaylı bir şekilde incelenecektir. Sodyumun Kimyasal Özellikleri Sodyum, atom numarası 11 olan ve 22.99 g/mol atomik kütleye sahip bir alkali metaldir. Oda sıcaklığında gümüş-beyaz renkte, yumuşak ve hafif bir metal olarak bulunur. Kimyasal özellikleri arasında şunlar yer alır:
Potasyumun Kimyasal Özellikleri Potasyum, atom numarası 19 olan ve 39.10 g/mol atomik kütleye sahip bir alkali metaldir. Sodyum gibi, potasyum da yüksek reaktiviteye sahip bir metaldir. Kimyasal özellikleri arasında şunlar yer alır:
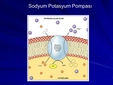
Sodyum ve Potasyumun Biyolojik Önemi Sodyum ve potasyum, insan vücudunun sağlıklı işleyişi için kritik öneme sahiptir. Bu elementler, hücresel işlevlerde, sinir iletiminde ve kas kasılmalarında önemli roller oynar. Örneğin:
Sodyum ve Potasyumun Endüstriyel Kullanımları Sodyum ve potasyum, çeşitli endüstriyel uygulamalarda yaygın olarak kullanılmaktadır. Bu elementlerin bazı kullanımları şunlardır:
Sonuç Sodyum ve potasyum, kimyasal özellikleri ve biyolojik önemi ile dikkat çeken alkali metaller arasında yer almaktadır. Yüksek reaktivite göstermeleri, birçok endüstriyel ve biyolojik süreçte kritik roller oynamalarını sağlamaktadır. Bu elementlerin doğru kullanımı, sağlıklı yaşam ve endüstriyel faaliyetlerin sürdürülebilirliği açısından büyük önem taşımaktadır. |































.webp)











Sodyum ve potasyumun kimyasal özelliklerini okuduğumda, bu elementlerin reaktivitesinin gerçekten çarpıcı olduğunu düşünüyorum. Özellikle su ile olan tepkimeleri insanı hayrete düşürebiliyor. Sodyumun suyla tepkimeye girdiğinde hidrojen gazı çıkarması ve potasyumun daha şiddetli bir reaksiyon göstermesi, bu elementlerin doğada neden bu kadar dikkat çekici olduğunu gösteriyor. Ayrıca, bu elementlerin biyolojik işlevleri de oldukça önemli. Sinir iletimi ve kas fonksiyonları için kritik roller oynamaları, sağlığımız açısından ne kadar vazgeçilmez olduklarını gözler önüne seriyor. Peki, bu elementlerin endüstriyel kullanımlarını düşündüğünüzde, sizce hangi alanda daha fazla ön plana çıkıyorlar?
Sodyum ve Potasyumun Endüstriyel Kullanımları
Benay, sodyum ve potasyumun reaktivitesi gerçekten de oldukça dikkat çekici. Su ile olan tepkimeleri, bu elementlerin doğadaki enerjik doğasını ve potansiyelini gözler önüne seriyor. Endüstriyel kullanımlarına baktığımızda, sodyum özellikle metalurji ve kimya endüstrisinde önemli bir rol oynamaktadır. Sodyum, birçok kimyasal süreçte reaktif bir madde olarak kullanılır ve ayrıca sodyum buharı lambaları gibi aydınlatma sistemlerinde de yer alır.
Potasyum ise gübre üretiminde kritik bir öneme sahiptir. Tarımda bitkilerin büyümesi için gerekli olan potasyum, hem verimliliği artırır hem de bitkilerin hastalıklara karşı direncini güçlendirir. Ayrıca, potasyum bileşikleri, cam ve seramik gibi malzemelerin üretiminde de kullanılır.
Sonuç olarak, bu iki elementin endüstriyel kullanımları oldukça çeşitlidir, ancak tarım ve kimya endüstrisi ön planda yer almaktadır. Bu alanlardaki kritik rolleri, hem ekonomik hem de ekolojik açıdan büyük önem taşımaktadır.