Potasyumun orbital dizilimi nasıldır ve özellikleri nelerdir?
Potasyumun elektronik yapısı, bu alkali metalin karakteristik özelliklerini belirleyen temel faktördür. Atom numarası 19 olan elementin elektron dizilimi, kimyasal davranışlarını ve reaktivitesini doğrudan etkileyen bir orbital düzeni sergiler. Bu yapı, elementin periyodik tablodaki konumuyla uyumlu şekilde tek değerlik elektronuna sahip olmasını açıklarken, aynı zamanda fiziksel ve kimyasal özellikleriyle biyolojik sistemlerdeki hayati rolünü de ilişkilendirmemizi sağlar.
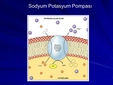
Potasyumun Orbital Dizilimi Potasyum (K), atom numarası 19 olan bir alkali metaldir. Elektron dizilimi, enerji seviyelerine göre elektronların dağılımını ifade eder. Potasyumun temel haldeki elektron konfigürasyonu şu şekildedir:
Bu dizilim, Aufbau prensibi, Hund kuralı ve Pauli dışlama ilkesine uygun olarak oluşturulmuştur. Potasyumun son elektronu 4s orbitaline yerleşir, çünkü 4s orbitali enerji olarak 3d orbitalinden daha düşüktür. Toplamda 19 elektron, sırasıyla doldurularak bu yapıyı oluşturur. Orbital diyagramı şöyle gösterilebilir: 1s (↑↓), 2s (↑↓), 2p (↑↓↑↓↑↓), 3s (↑↓), 3p (↑↓↑↓↑↓), 4s (↑). Bu, potasyumun tek değerlik elektronuna sahip olduğunu ve kimyasal reaktivitesini açıklar. Potasyumun Özellikleri Potasyum, periyodik tablonun 1. grubunda yer alan yumuşak, gümüşi-beyaz renkli bir metaldir. Genel özellikleri şunlardır:
Özetle, potasyumun orbital dizilimi onun reaktif doğasını açıklar ve özellikleri, hem doğal hem de endüstriyel uygulamalarda değerli kılar. |































.webp)