
Potasyumun atom ağırlığı nedir?
Potasyum, kimyasal sembolü K olan ve alkali metaller grubuna ait bir elementtir. Atom ağırlığı yaklaşık 39.10 u olarak kabul edilir. Üç ana izotopu olan K-39, K-40 ve K-41 ile birlikte, potasyum canlılar için hayati öneme sahip bir elementtir ve birçok endüstriyel alanda kullanılır.
Potasyumun Atom Ağırlığı Nedir?Potasyum, kimyasal sembolü K olan bir elementtir ve periyodik tabloda alkali metaller grubuna aittir. Potasyumun atom ağırlığı, belirli bir elementin izotoplarının doğal abundansı ile bu izotopların atom ağırlıklarının bir ortalaması olarak tanımlanır. Potasyumun atom ağırlığı yaklaşık olarak 39.10 u (atomik kütle birimi) olarak kabul edilmektedir. Potasyumun İzotopları Potasyumun üç ana izotopu bulunmaktadır:
Bu izotoplardan K-39, potasyumun en bol bulunan izotopudur ve doğal potasyumun yaklaşık %93.1'ini oluşturur. K-40, radyoaktif bir izotop olup, doğada çok az miktarda bulunur ve K-41 ise doğal potasyumun yaklaşık %6.9'unu temsil eder. Potasyumun Atom Ağırlığının Hesaplanması Potasyumun atom ağırlığı, izotopların doğal abundansları ve atom ağırlıkları kullanılarak hesaplanır. Örneğin:
Bu izotopların ortalama atom ağırlığı aşağıdaki formülle hesaplanır:\[ \text{Atom Ağırlığı} = (A_1 \times f_1) + (A_2 \times f_2) + (A_3 \times f_3) \]Burada \(A\) izotopların atom ağırlıkları, \(f\) ise ilgili izotopların doğal abundansını temsil eder. Potasyumun Önemi ve Kullanım Alanları Potasyum, canlı organizmalar için hayati öneme sahip bir elementtir. Vücutta sıvı dengesinin düzenlenmesinde, sinir iletimi ve kas kasılmaları gibi önemli biyolojik işlevlerde rol oynar. Ayrıca, potasyum bitkilerin büyümesi için gereklidir ve tarımda gübre olarak yaygın bir şekilde kullanılmaktadır. Potasyum ayrıca, endüstriyel alanlarda ve çeşitli kimyasal süreçlerde de önemli bir bileşendir. Örneğin, potasyum hidroksit, sabun yapımında ve çeşitli kimyasal reaksiyonlarda kullanılırken, potasyum klorür ise gıda sanayinde ve ilaç sektöründe yer almaktadır. Sonuç Potasyumun atom ağırlığı, yaklaşık 39.10 u olarak kabul edilmekte olup, bu değer potasyumun izotoplarının doğal abundansı ve atom ağırlıkları dikkate alınarak hesaplanmaktadır. Potasyum, hem biyolojik hem de endüstriyel açıdan önemli bir elementtir ve çeşitli alanlarda geniş çapta kullanılmaktadır. Bu nedenle, potasyumun atom ağırlığı ve özellikleri üzerine yapılan çalışmalar, bilimsel ve pratik açıdan büyük bir önem taşımaktadır. |































.webp)











Potasyumun atom ağırlığı hakkında verdiğin bilgiler oldukça bilgilendirici. Ancak, bu atom ağırlığının hesaplanmasında hangi izotopların daha fazla etkili olduğunu merak ediyorum. Özellikle K-40 izotopunun radyoaktif olması potasyumun genel özelliklerini nasıl etkiliyor? Ayrıca, potasyumun biyolojik işlevleri arasında sinir iletimi ve kas kasılması gibi süreçlerin detayları hakkında daha fazla bilgi verebilir misin?
Sayın Nevbar bey, sorularınızı sırayla cevaplandırayım:
Potasyum İzotopları ve Atom Ağırlığı
Potasyumun doğal olarak bulunan üç izotopu vardır: K-39 (%93.26), K-41 (%6.73) ve K-40 (%0.01). Atom ağırlığının hesaplanmasında en fazla etki K-39 izotopundan gelir çünkü en yüksek bolluk oranına sahiptir. K-41 izotopu da önemli bir katkı sağlarken, K-40'ın çok düşük bolluk oranı nedeniyle atom ağırlığına katkısı minimal düzeydedir.
K-40 İzotopunun Etkileri
K-40 radyoaktif bir izotoptur ve 1.25 milyar yıllık yarı ömre sahiptir. Bu radyoaktivite:
- Doğal radyasyon kaynağı oluşturur (insan vücudundaki potasyumun yaklaşık %0.012'si K-40'tır)
- Jeolojik tarihleme yöntemlerinde kullanılır
- Potasyumun genel kimyasal özelliklerini etkilemez, çünkü izotopların kimyasal davranışları benzerdir
Biyolojik İşlevler
Potasyumun sinir iletimindeki rolü:
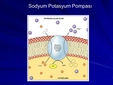
- Hücre içi ve dışı potasyum konsantrasyon farkı, dinlenim zar potansiyelini oluşturur
- Aksiyon potansiyeli sırasında potasyum kanalları açılır ve K+ iyonları hücre dışına çıkar
- Bu iyon hareketi, zar potansiyelinin yeniden dinlenim değerine dönmesini sağlar
Kas kasılmasındaki işlevi:
- Sinir uyarısı kas hücresine ulaştığında, sarkoplazmik retikulumdan kalsiyum salınır
- Potasyum, hücre zarındaki elektrokimyasal dengenin korunmasında kritik öneme sahiptir
- Potasyum dengesizlikleri kas zayıflığı, kramp veya felç gibi sorunlara yol açabilir
Bu sistemlerde sodyum-potasyum pompası (Na+/K+ ATPaz) hayati önem taşır ve hücresel enerjinin yaklaşık %20-40'ını kullanır.